Senyawa aromatik sangat stabil
karena memiliki ikatan phi yang terkonjugasi oleh karena itu untuk
menghindari hilangnya energi kestabilan yang dimiliki pada senyawa aromatik maka senyawa aromatik lebih cenderung untuk
menjalani reaksi substitusi. Cincin aromatik yang mengandung kerapatan elektron
yang tinggi sehingga dapat
bereaksi dengan spesies yang kekurangan elektron (elektrofil), dan
reaksi substitusi
yang terjadi padanya disebut reaksi
substitusi elektrofilik.
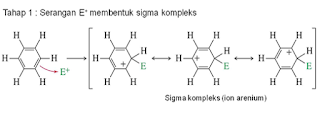
Mekanisme
pada Substitusi benzena dengan pereaksi elektrofil (E+) terjadi dalam dua tahap:
1.
pereaksi mengadisi ke satu atom karbon inti benzena menghasilkan karbokation
dalam mana muatan positif terdelokalisasi pada tiga atom karbon.
Pada tahapan ini energi
stabilitas (energi resonansi) pada cincin aromatik telah hilang karena
perusakan sistem phi aromatik yang disebabkan oleh adisi elektrofili pada suatu
karbon cincin dan reaksi biasanya lambat oleh karena itu dibutuhkan elektrofil kuat dan penggunaan
katalis.
2. proton
tereliminasi dari spesies teradisi
Pada tahapan ini energi
resonansi aromatik tercapai kembali dengan melepaskan satu proton. Energi
aktivasi pada tahapan ini lebih rendah karena pulihnya sistem aromatik.
Subtitusi Elektrofilik Pada Benzen tersubtitusi (Subtitusi Elektrofilik
Kedua)
Subtituen yang sudah ada pada cincin aromatik
menentukan posisi yang diambil oleh subtituen yang baru pada substitusi kedua
maupun ketiganya.
Pengaruh
yang diberikan bergantung kepada beberapa faktor, yaitu:
a.
Akseptor Induksi. Efek ini diperlihatkan oleh subtituen yang mengandung
atom yang memiliki keelektronegatifan lebih besar dari atom H yang terhubung
pada cincin benzen.
Contoh: -OCH3, -NH2,
-Cl, -NO2
b.
Efek Resonansi.
Aseptor resonansi. Konjugasi antara orbital p
digambarkan melalui struktur resonansi dengan muatan positif pada cincin
benzen.
Contoh: -COR, -NO2, -SO3H
Donor Resonansi. Konjugasi antara orbital-p digambarkan melalui
struktur resonansi dengan muatan negatif pada cincin benzen.
Contoh: -OCH3, -NH2, -Cl, -phenyl
c.
Efek Hiperkonjugasi
Donor Hiperkonjugasi. Konjugasi yang melibatkan
orbital-s digambarkan melalui struktur resonansi non klasik (mengijinkan
pemutusan ikatan-s) dengan muatan negatif pada cincin benzen .
Contoh: -CH3, -Alkyl
Akseptor Hiperkonjugasi. Konjugasi yang melibatkan
orbital sigma, digambarkan melalui struktur resonasni non kalsik (mengijinkan
pemutusan ikatan-s) dengan muatan positif pada cincin benzen.
Examples: -CF3
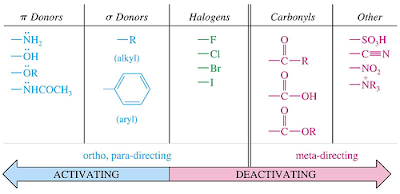
Berdasarkan posisi substituen kedua:
1. Seluruh donor elektron akan mengarahkan subtituen yang datang pada
posisi orto dan para (dengan terdapat beberapa pengecualian).
Contoh: -CH3, -NR2, -OR, -Cl, -Br,
-CH=CH2
 |
| mekanisme reaksi serangan orto dan para |
 |
|
Brominasi Fenol
|
Pada serangan orto atau para,
salah satu penyumbang pada ion benzenonium intermediet menempatkan muatan
positif pada karbon pembawa hidroksil. Pergeseran pasangan elektron bebas dari
oksigen ke karbon positif menyebabkan muatan positif terdelokalisasi lebih jauh
yaitu oksigen. Sedangkan pada serangan meta tidak diperoleh hasil ini.
2. Akseptor elektron akan mengarahkan subtituen pada
posisi meta.
Contoh: -NO2, -NH3+,
-COR, -CF3
 |
| mekanisme reaksi serangan meta |
Pada posisi orto atau para
memiliki dua muatan positif yang bersebelahan terjadi tolak menolak (susunan
yang tak diinginkan) sedangkan meta tidak ada intermediet yang seperti ini
sehingga serangan meta lebih disukai.
Subtitusi Elektrofilik Pada Benzen tersubtitusi (Subtitusi Elektrofilik Ketiga)
Salah satu sifat elektrofil dapat mengadisi ke
posisi yang sudah tersubstitusi, proses ini dikenal
sebagai reaksi-ipso. Karbokation yang terbentuk dapat bereaksi dengan berbagai
reaksi salah satunya adalah melalui perginya substituen sebagai kation atau
yang ekuivalen dengannya, sebagai contoh:
Pada
reaksi tersebut substituen Br menggantikan substituen COOH pada posisi orto dan
para sedangkan pada posisi meta kurang disukai.
Berdasarkan
persamaan Hammet pada posisi para dan meta dapat berlaku persamaan hammet
tetapi pada posisi orto tidak, hal ini dikarenakan adanya halangan sterik yang
kuat pada posisi tersebut seperti yang
dijelaskan pada mekanisme berikut:
Forum Diskusi:
1.
Bagaimana efek pengaktif dan pendeaktif dapat
meberikan efek pada gugus pengarah orto,meta maupun para?
2. Pada contoh
substitusi ketiga (penjelasan diatas) mengapa posisi meta tidak disukai?
3. Bagaimana penjelasan
(kestabilan, efek pengaktivasi dan posisi substituen) reaksi subsitusi pada
nitrasi toluena berikut?
DAFTAR
PUSTAKA
Fessenden, R.J
dan J.S Fessenden. 1982. Kimia Organik Jilid 1 Edisi ketiga.
Jakarta : Erlangga.
Jakarta : Erlangga.
Firdaus. 2014. Kimia
Organik Sintesis Bagian 2.
Makasar: Unhas-press
Hart, H., L. E.
Craine dan D. J. Hart. 2003. Kimia Organik. Jakarta: Erlangga.









Tidak ada komentar:
Posting Komentar