Reaksi substitusi senyawa
organic sangat dipengaruhi oleh peran dari gugus pergi dan juga dipengaruhi
oleh gugus tetangga dimana hal ini dapat mempengaruhi kecepatan reaksi serta
produk yang dihasilkan.
Pengaruh
Gugus Pergi
Pada reaksi substitusi
nukleofilik diketahui adanya serangan nukleofil yang menyebabkan
tereliminasinya gugus pergi. Dimana Gugus pergi adalah substituen yang terlepas dari
substrat, yang berarti atom atau gugus apa saja yang di geser dari ikatannya
dengan atom karbon karena berdasarkan sifatnya Gugus pergi merupakan suatu basa yang lemah jika di bandingkan
dengan nukleofil. Sehingga untuk berjalannya reaksi perlu diketahui
sifat dari kestabilan gugus pergi yang baik pada reaksi subtitusi SN1 atau SN2. |
| Reaksi nukleofilik |
Substitusi kerap terjadi
terhadap ikatan C-X (karbon halide) yang dimana unsur halida merupakan gugus
perginya dan terdapat faktor penting
pada berlangsungnya reaksi yakni kekuatan dari ikatan C-X dan kestabian ion
halida.
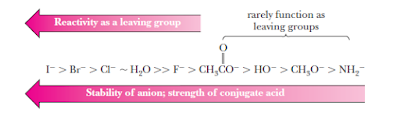
Berdasarkan kekuatan ikatan
halida tersebut diketahui bahwa ikatan C-I lebih mudah digantikan
(tersubstitusi) dibandingkan C-F sehingga Iodin adalah gugus pergi yang lebih
baik. Sedangkan berdasarkan nilai pKa, HI adalah asam yang lebih kuat sehingga lebih mudah terionisasi
menjadi H+ and I–.
Pengaruh
Gugus Tetangga
Pada suatu reaksi adanya partispasi gugus tetangga
yang memiliki pasangan elektron bebas (PEB) dapat menyebabkan kecepatan reaksinya lebih
besar daripada yang
diharapkan, dan konfigurasi pada atom kiralnya
dipertahankan. Mekanis reaksi SN2
dengan adanya pengaruh ugus tetangga terjadi dengan 2 tahap.
ü Tahap pertama, gugus tetangga bertindak sebagai nukleofil
yang memaksa gugus-pergi untuk keluar, tapi tetangga
tersebut masih tetap bertahan terikat pada atom karbon di
mana gugus-pergi terikat sebelumnya.
ü Tahap kedua, nukleofil eksternal
mengusir gugus tetangga melalui serangan dari arah belakang.
Kecepatan
reaksi yang teramati adalah lebih cepat daripada jika Y menyerang secara langsung. Hal ini karena jika reaksi di mana Y
menyerang secara langsung adalah reaksi yang lebih cepat
maka reaksi itulah yang seharusnya terjadi, namun fakta yang diperoleh tidak mendukung untuk terjadinya
reaksi tersebut. Hukum kecepatan reaksi dalam
mekanisme partisipasi gugus-tetangga adalah order satu, Y tidak mengambil bagian dalam tahap penentu kecepatan
reaksi.
Sehingga
diketahui serangan Z lebih cepat daripada serangan Y. Karena gugus Z (gugus tetangga) lebih tersedia pada posisi
yang tepat; sedangkan untuk bereaksi dengan Y, Y harus
bertumbukan dengan substrat. Reaksi antara substrat dengan
Y melibatkan penurunan entropi aktivasi yang besar (ΔSǂ) karena dalam keadaan transisi, reaktan jauh kurang
bebas daripada sebelumnya. Reaksi Z
melibatkan pelepasan ΔSǂ yang jauh lebih kecil.
Partisipasi Gugus Tetangga
Melalui Ikatan p dan s
Partisipasi melalui ikatan p C=C serta ikatan s C-C
dan C-H. Pastisipasi ini ada yang melibatkan spesies-antara yang disebut dengan karbokation non-klasik. Di dalam
karbokation non-klasik, muatan positif berlokasi pada satu
atom karbon atau terdelokalisasi melalui resonansi yang melibatkan pasangan elektron bebas atau ikatan rangkap
dua atau ikatan rangkap tiga dalam posisi alilik. Jika
suatu ikatan rangkap dua atau rangkap tiga karbonkarbon berpartisipasi dalam proses perginya gugus-pergi untuk
membentuk karbokation, maka hal itu dimungkinkan melibatkan
karbokation non-klasik.
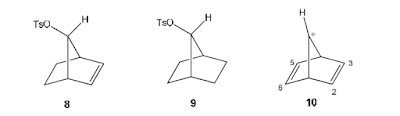
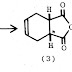
Contohnya: C=C sebagai gugus tetangga
Bukti yang kuat bahwa gugus
C=C dapat bertindak sebagai gugus tetangga adalah asetolisis senyawa 8 lebih cepat 1011 kali
daripada senyawa 9, dan berlangsung dengan mempertahankan
konfigurasi. Hal ini disebabkan oleh gugus C=C yang membantu perginya gugus Ots (kebedaan karbokation
non-klasik) yang
ditunjukkan pada kation norbornaldienil (10)
yang relatif stabil.
 |
| kereaktifan reaksi asetolisis dengan adanya gugus tetangga |
Jadi
ada interaksi antara karbon bermuatan dengan satu ikatan rangkap dua, yang mana dapat dijadikan bukti untuk keberadaan ion
non-klasik yang analog dengannya.
Forum
Diskusi:
1.
apa penyebab gugus halida menjadi gugus pergi yang baik?
2.
selain halida, gugus apa yang dapat dijadikan sebagai gugus pergi pada
reaksi substitusi?
reaksi substitusi?
3.
adakah kriteria gugus tetangga yang baik, yang dapat meningkatkan
laju reaksi?
laju reaksi?
DAFTAR PUSTAKA
Firdaus, 2013, Kimia Organik Fisik II. Makassar:
Universitas Hasanuddin.
William H. B., C. S. Foote., B. L. Iverson., E V. Anslyn. 2009. Chemistry, Sixth Edition. Usa: Brooks/Cole, Cengage Learning.





Tidak ada komentar:
Posting Komentar