Pada setiap reaksi selalu berlangsung
perubahan entalpi (∆H), Perubahan entropi (∆ S) dan perubahan energi bebas (∆G)
yang dimana sesuai prinsip termodinamika keseluruhan ini tidak bergantung pada
jalur yang diikuti oleh reaksi. Dimana hubungan ketiga variabel tersebut
adalah:
∆G
= ∆H-T. ∆S
Selanjutnya diketahui bahwa harga ∆G
berhubungan dengan kesetimbangan K, sebagai berikut:
∆G=
-RT ln K
Entalpi dari sejumlah senyawa organik
dapat ditabulasikan dari data termokimia atau data energi ikatan. Jika harga
perubahan energi bebas dalam keadaan standar ∆G⁰ besar dan positif, ini berarti bahwa reaksi
tidak akan berlangsung. Sebaliknya apabila harga tersebut besar dan negatif,
ini berarti bahwa reaksi mungkin akan berlangsung. Untuk terjadinya reaksi secara spontan, energi
bebas produk harus lebih rendah daripada energi bebas reaktan, yakni ∆G harus
negatif. Reaksi dapat saja berlangsung melalui jalan lain, tapi tentu saja
hanya jika energi bebas ditambahkan.
Gambar 1. Profil energi bebas reaksi tanpa spesies-antara di
mana produk energi
bebas
produk lebih rendah daripada energi bebas reaktan
Pendekatan Benson dalam menghitung ∆H⁰f
untuk suatu
molekul adalah dengan jalan menambahkan ∆H⁰f
dari
berbagai gugus dalam molekul (gugus dalam hal ini dapat berupa atom dan
ligan). Contohnya propan mengandung gugus C-(H)3(C)
dan satu gugus C-(H)2(C)2 (∆H⁰f
4,75 kkal/mol ) jadi ∆H⁰f
propan =
(-10,164,95) kkal/mol= -25,11 kkal/mol untuk harga eksperimennya sebesar -24,82
kkal/mol.
Dalam
suatu reaksi kimia, ada kalanya dapat mengalami reaksi kompetisi dalam menghasilkan
produk yang berbeda. Misalnya:
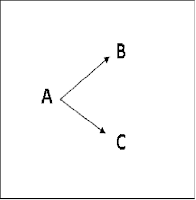
Gambar
2. memperlihatkan profil energi-bebas
untuk suatu reaksi dalam misalnya B lebih stabil secara termodinamika daripada C
(∆G lebih rendah), tapi C terbentuk lebih cepat
Pada
Gambar 2. Jika tidak ada satupun reaksi yang revesibel maka C akan terbentuk lebih
banyak karena terbentuk lebih cepat. Produk tersebut dikatakan terkontrol
secara kinetik (kinetically controlled). Akan tetapi, jika reaksi adalah
reversibel maka hal tersebut tidak menjadi penting. jika proses dihentikan sebelum
kesetimbangan tercapai maka reaksi akan dikontrol oleh kinetik karena akan
lebih banyak diperoleh produk yang cepat terbentuk. Akan tetapi jika reaksi
dibiarkan sampai mendekati kesetimbangan maka produk yang akan dominan adalah B
karena B lebih stabil dan terjadi dengan spontan. Di bawah kondisi tersebut, C yang
mula-mula terbentuk akan kembali ke A, sementara B yang lebih stabil tidak berkurang
banyak. Maka dikatakan bahwa produk terkontrol secara termodinamika (thermodynamically
controlled).
Pada aspek termodinamika tidak tepat digunakan untuk menjadi acuan untuk memperkirakan kecepatan reaksi. namun kecepatan reaksi dapat diperkirakan berdasarkan kontrol kinetika yaitu berdasarkan orde atau tingkat reaksi yang menentukan harga konstanta kecepatan reaksi (k) dan energi aktivasi (Ea). Reaksi akan makin cepat apabila k semakin besar atau Ea makin kecil. Selanjutnya berdasarkan orde, k dan Ea maka mekanisme suatu reaksi atau jejak suatu reaksi dapat ditentukan. Dengan mengetahui mekanisme suatu reaksi dapat diarahkan untuk menghasilkan suatu produk yang diharapkan berdasarkan manipulasi harga k dan Ea, karena pada umumnya reaksi molekul organik merupakan suatu campuran.
Forum Diskusi: Berdasarkan pemaparan materi diatas menurut anda, bagaimana cara mengkontrol suatu reaksi yang mana bila kecepatan yang rendah (reaksi yang lama) menyebabkan terbentuknya hasil samping yang tidak diinginkan berdasarkan kontrol kinetik dan atau kontrol termodinamikanya?
DAFTAR PUSTAKA
Firdaus. 2009. Kimia Organik Fisis I. Makasar: Unhas-press.
Nurhayati dan Subagjo. 1999. "Analisis Thermodinamika Dehidrasi n-
butanol". Prosiding Seminar Nasional Fundamental dan Aplikasi
Teknik Kimia.
butanol". Prosiding Seminar Nasional Fundamental dan Aplikasi
Teknik Kimia.
Tobing, R.L. 1989. Kimia Organik Fisik. Jakarta: Kemendikbud.




Tidak ada komentar:
Posting Komentar