Pembentukan Ikatan karbon-Karbon (C-C)
Pembentukan
ikatan antara dua atom digambarkan dengan kemajuan overlap orbital-orbital atom yang membentuk ikatan.,
pembentukan ikatan C-C bisa terjadi melalui beberapa reaksi:
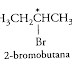
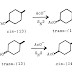
ü Reaksi antara karbon nukleofil dan karbon elektrofil, seperti
pada gambar di bawah ini :
ü Reaksi radikal bebas tetapi dalam sintesis tidak
digunakan karena reaksi yang tak terkenali dapat menyebabkan reaksi berantai:
ü Reaksi adisi pada ikatan rangkap yakni:
1. Hidroksilasi Alkena
Merupakan peristiwa adisi gugus –OH pada kedua karbon ikatan rangkap. Dapat terjadi dengan mereaksikan alkena dengan osmium tetroksida. Reaksi terjadi secara syn stereokimia dan menghasilkan 1,2-dialkohol, atau disebut diol.
Hidroksilaksi alkena tidak melibatkan pembentukan intermediet
karbokation tetapi intermediet cyclic osmate yang terbentuk dalam satu tahap adisi OSO4 pada alkena. Cyclic osmat ini kemudian dipecah menggunakan sodium bisulfat (NaHSO3).
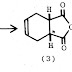
2. Reaksi ozonolisis
Ozon (O3) biasanya digunakan untuk memecah ikatan rangkap dalam alkena. Ozon dapat mengadisi dengan cepat pada alkena membentuk intermediet molozonide
yang dengan
cepat pula mengalami penataan ulang membentuk ozonida.
Ozonida kemudian diperlakukan dengan reduktor seperti logam
zinc dalam asam asetat
untuk mengubahnya menjadi senyawa karbonil. Hasil akhir ozonolisis adalah pecahnya ikatan rangkap C=C dan digantikan dengan ikatan rangkap dengan oksigen.
Penyerangan Nukleofil
Di dalam substitusi nukleofilik, pereaksi penyerang
(nukleofil) membawa
sepasang elektron kepada substrak,
menggunakan pasangan elektron tersebut untuk membentuk
ikatan baru, dan gugus-pergi (nucleofuge) pergi menjauh dengan membawa satu pasangan elektron.
Ø
Mekanisme SN2
SN2 adalah simbol yang diberikan untuk substitusi
nuklefilik bimolekul. Di dalam mekanisme ini terdapat serangan
pada sisi belakang, nukleofil mendekati substrat dari posisi
180° menjauh dari gugus-pergi. Reaksi tersebut adalah proses satulangkah tanpa spesies-antara, ikatan C-Y terbentuk bersamaan dengan putusnya ikatan C-X.
 |
Mekanisme SN2
|
Energi yang
diperlukan untuk memutuskan ikatan C-X disuplai oleh energi pembentukan ikatan C-Y yang terjadi secara bersamaan dengannya. Pada saat keadaan transisi tercapai, atom karbon pusat segera berubah dari hibrida sp3 menjadi hibrida sp2 dengan
orbital p yang tegak lurus pada bidang datar. Satu
cuping (lobe) orbital p overlap dengan orbital nukelofil dan cuping yang lain overlap dengan orbital gugus-pergi. Inilah sebabnya
sehingga
di dalam mekanisme SN2 tidak pernah ditemukan
serangan nukleofil dari sisi depan (sisi di mana
gugus-pergi akan pergi). Selama keadaan
transisi, ketiga gugus yang tidak bereaksi akan
sebidang dengan atom karbon pusat. Keempatnya benar-benar akan sebidang jika gugus yang masuk sama dengan gugus yang keluar.
Ø
Mekanisme SN1
Tahap pertama reaksi SN1 adalah langkah lambat ionisasi substrat, dan langkah ini sebagai langkah penentu
kecepatan reaksi. Langkah kedua adalah reaksi cepat
antara zat-antara
dengan nukleofil. Proses ionisasi selalu dibantu oleh pelarut karena kebutuhan energi untuk memutuskan ikatan sebagian besar dipenuhi oleh solvasi R+ dan X. Di dalam
sistem tanpa pelarut, proses sederhana ini tidak akan terjadi, kecuali suhu ditinggikan. Kebanyakan reaksi SN1, beberapa produk terbentuk bukan dari karbokation bebas melainkan dari pasangan-pasangan ion. Menurut
konsepnya, reaksi SN1
berlangsung dalam cara:
 |
Mekanisme SN1
|
Dalam hal
ini, spesies 5 adalah pasangan ion yang rapat, 6 adalah pasangan
ion
yang terpisah atau tersekat oleh pelarut, dan 7 adalah
pasangan ion yang tarurai
(masing-masing ion dikerumuni oleh
molekul-molekul pelarut). Di dalam spesies 5 dan 6, X- disebut counterion atau gegenion. Produk
reaksi dapat dihasilkan dari serangan nukleofil dalam tahap
yang mana saja. Serangan nukleofil pada spesies 5 akan menghasilkan produk inversi karena nukleofil tidak dapat menyerang
dari sisi
di mana X- berada.
Penyerangan Elektrofil
Pereaksi yang mengambil pasangan elektron disebut elektrofil
dan
reaksinya disebut elektrofilik.
Dengan mekanisme:
 |
Mekanisme SE
Reaksi elektrofilik biasanya terjadi pada senyawa
aromatis yang dimana telah dijelaskan pada materi sebelumnya.
Forum Diskusi:
1. Pada pembentukan Ikatan
karbon-Karbon
(C-C) reaksi radikal jarang digunakan untuk
sintesis mengapa demikian?
2. Apa yang menyebabkan senyawa aromatik
jarang mengalami substitusi nukleofil?
3. Apa yang menjadi faktor penting
suatu reaksi dapat mengalami penyerangan elektrofil maupun nukleofil?
DAFTAR
PUSTAKA
Fessenden, R.J dan J.S. Fessenden. 1982. Organic Chemistry Third Edition. Jakarta :
Erlangga.
Firdaus, 2013, Kimia Organik Fisik II. Makassar: Universitas
Hasanuddin.
Hart, H., Crain,L.E., Hart,D.J. 2003. Kimia Organik. Jakarta : Erlangga.





Tidak ada komentar:
Posting Komentar