Berdasarkan gugus fungsi yang terdapat pada suatu senyawa organik dapat memberikan dampak pada sifat keasaman atau kebasaan senyawa tersebut. Berikut terdapat beberapa senyawa organik yang dapat
berfungsi sebagai asam dan basa.
ü
Sifat
Asam Senyawa Organik
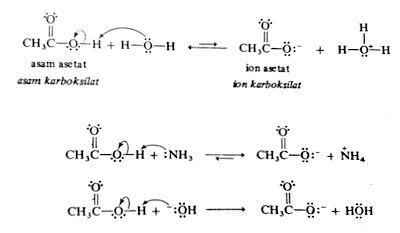
Asam merupakan spesies dengan kecenderungan menyumbangkan proton. Asam organik dicirikan oleh adanya atom hidrogen yang terpolarisasi positif. Terdapat dua macam asam organik, yang pertama adanya atom hidrogen yang terikat dengan atom oksigen, seperti pada metil alkohol dan asam asetat. Kedua, adanya atom hidrogen yang terikat pada atom karbon di mana atom karbon tersebut berikatan langsung dengan gugus karbonil (C=O), seperti pada aseton. Senyawa organik yang mengandung
gugus karboksilat (-COOH) adalah asam lemah. Senyawa-senyawa yang mengandung gugus
karboksilat disebut asam karboksilat contohnya asam asetat (CH3COOH).
Salah satu alasan untuk keasaman asam karboksilat adalah kepolaran ikatan O-H
Berikut adalah kelompok
karboksilat:
Dengan adanya basa, H+ ditarik dari gugus karboksilat dan
terbentuklah anion karboksilat. Karena asam karboksilat hanya asam lemah,
reaksi ini tidak berlangsung sampai sempurna kecuali bila digunakan basa yang
lebih kuat dari air seperti yang dinyatakan oleh panah reaksi sebagai berikut:
Metil alkohol mengandung ikatan O-H dan karenanya bersifat asam lemah, asam asetat juga memiliki ikatan O-H yang bersifat asam lebih kuat. Asam asetat bersifat asam yang lebih kuat dari metil alkohol karena basa konjugat yang terbentuk dapat distabilkan melalui resonansi, sedangkan basa konjugat dari metil alkohol hanya distabilkan oleh keelektronegativitasan dari atom oksigen.
 |
| Perbandingan keasaman metil alkohol dengan asam asetat |
Tetapan
Keasaman
Tetapan keasaman (K) menggambarkan seberapa jauh reaksi berlangsung
sampai berkesudahan. Untuk ionisasi suatu asam dalam air, tetapan ini disebut
tetapan keasaman Ka, yang dituliskan
dalam persamaan umum berikut:
Semakin terionisasi suatu asam maka semakin besar nilai Ka
karena nilai dalam pembilang semakin besar. Asam yang lebih kuat mempnyai nilai
Ka yang lebih besar.
ü
Sifat
Basa Senyawa Organik
Basa merupakan
spesies dengan kecenderungan menerima proton. Basa organik dicirikan dengan adanya atom dengan pasangan elektron bebas yang dapat mengikat proton.Senyawa-senyawa yang mengandung atom nitrogen adalah salah satu contoh basa organik, tetapi senyawa yang mengandung oksigen dapat pula bertindak sebagai basa ketika direaksikan dengan asam yang cukup kuat. Amina adalah golongan senyawa organik
yang secara struktural sama dengan amonia; suatu amina mengandung atom nitrogen
yang terikat secara kovalen dengan satu atau lebih atom karbon dan mempunyai
sepasang elektron menyendiri.
Beberapa amina yang umum:
Amina, seperti amonia adalah basa lemah dan mengalami reaksi
reversibel dengan air atau asam lemah lainnya. (penggunaan asam kuat mendorong
reaksi sampai berkesudahan):
Tetapan
Kebasaan
Reaksi reversibel dari basa lemah dengan air, seperti reaksi
dari asam lemah dengan air, menghasilkan konsentrasi ion yang kecil, tetapi
tetap pada kesetimbangan. Untuk ionisasi suatu asam dalam air, tetapan ini
disebut tetapan kebasaan Kb, yang
dituliskan dalam persamaan umum berikut:
Dengan bertambah kekuatan bas:a, nilai Kb bertambah dan nilai pKb berkurang. Semakin kecil nilai untuk pKb semakin bersifat basa.
Forum Diskusi: berdasarkan materi yang telah disampaikan
1. bagaimana aseton dan metil alkohol dapat bertindak sebagai asam dan basa organik?
2. bagaimana keasaman aseton dapat disebabkan oleh adanya kemampuan resonansi?
DAFTAR PUSTAKA
Fessenden, R.J dan J.S Fessenden. 1982. Kimia Organik Jilid 1 Edisi ketiga. Jakarta : Erlangga.
http://perpustakaan.stik-avicenna.ac.id/wp-content/uploads/2014/11/KIMIA-ORGANIK-I.pdf








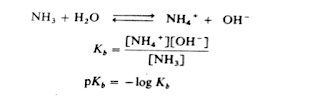

Tidak ada komentar:
Posting Komentar