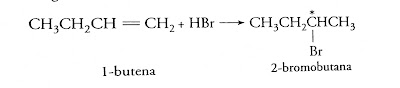Stereoisomer dapat digolongkan dengan tiga cara. Yakni dapat berupa konformer atau isomer konfigurasional; dapat bersifat kiral atau akiral; dan juga dapat berupa enantiomer atau diastereomer.
Seberapa penting stereokimia dalam reaksi kimia?
Sebelumnya mari kita lihat pengaruh stereoisomer terhadap aktivitas biologisnya, yakni pada:
Enantiomer dan Aktivitas Biologis
Enantiomet-enantiomer dari molekul kiral dapat mengakibatkan beragam respons biologis bila masuk ke dalam makhluk hidup. Rasa, bau, kemanjuran obat, daya racun, sifat bakterisidal, fungisidal, insektisidal, dan sifat lain dari enantiomer sering sangat beragam. Berikut ini contohnya:
ü Asam amino (R)-asparagina rasanya manis,
sementara (S)-asparagina rasanya pahit.
ü (R)-karvon berbau mentol, sementara (S)-karvon
menyebabkan harum jintan
ü(S)naproksen merupakan obat anti-inflamasi penting,
padahal enantiomernya merupakan racun hati.
Bagaimana bisa dua molekul yang strukturnya serupa sebagai enantiomer memiliki aktivitas biologis yang begitu berbeda? Alasannya ialah bahwa aktivitas biologis diawali dengan pengikatan molekul kecil pada molekul reseptor (penerima) dalam makhluk hidup dan membentuk kompleks molekul kecil-reseptor. Reseptor umumnya berupa molekul kiral, tidak rasemik seperti prorein, karbohidrat kompleks, atau asam nukleat yang berikatan dengan baik hanya dengan salah satu dari sepasang enantiomer. Karena bentuk tiga dimensinya yang berbeda, (R)-asparagina mengikat reseptor pada manusia yang memicu rasa manis, sedangkan (S)asparagina tidak berikatan dengan reseptor itu, melainkan mengikat reseptor yang bentuknya berbeda yang menghasilkan rasa pahit.
Sekarang terdapat banyak contoh: satu enantiomer dari molekul kiral menimbulkan respons biologis yang disukai, sementara enantiomer lain menghasilkan respons yang merusak (contohnya, naproksen). Jadi, semakin penting bagi obat-obatan kiral dan senyawa agrokimia untuk dipasarkan sebagai enantiomer tunggal, Bukannya campuran rasemik. Baru-baru ini telah didorong pengembangan metode sintesis baru yang hanya menghasilkan satu enantiomer dari molekul kiral, melalui proses yang disebut sintesis asimetri.
Lalu, Seberapa penting stereokimia dalam reaksi kimia?
Jawabannya tergantung pada sifat reaktan. Seperti:
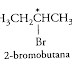
● Pembentukan produk kiral dari reaktan akiral, contohnya: adisi hidrogen bromida pada 1-Butena menghasilkan 2-bromobutana (sesuai aturan Markovnikov):
Produknya memiliki 1 pusat stereogenik, ditandai dengan bintang, tetapi kedua enantiomer ini berbentuk dalam jumlah yang tepat sama. Produknya ialah campuran resmik karena ion bromida dapat bergabung dengannya dari atas atau bawah dengan peluang yang tepat sama, yakni:
 |
| gambar 2 |
Dari reaksi ini diketahui bahwa bila reaksi antara dua reagen akiral menghasilkan produk kiral, hasilnya selalu campuran rasemik (50 : 50) enantiomer. Andaikan kita ingin memperoleh setiap enantiomer murni dan bebas dari enantiomer lain. Proses pemisahan campuran rasemik menjadi enantiomernya dinamakan resolusi. Karena enantiomer memiliki sifat akiral yang identik, bagaimana kita memisahkan campuran rasemik ke dalam komponen-komponennya?
Jawabnya ialah mengonversinya menjadi diastereomer, pisahkan diastereomer dan kemudianmerekonversi diastereomer yang sekarang telah terpisah menjadi enantiomernya kembali.
Untuk memisahkan dua enantiomer pertama-tama kita reaksikan dengan reagen kiral. Produknya
akan berupa sepasang diastereomer. Diastereomer ini telah kita ketahui berbeda dalam semua jenis
sifatnya dan dapat dipisahkan melalui metode biasa. Prinsip ini diilustrasikan dalam persamaanberikut:
Sesudah diastereomer-diasrereomer ini dipisahkan, kemudian kita melaksanakan reaksi yang meregenerasi reagen kiral itu dan memisahkan enantiomernya.
PERTANYAAN:
1. Sekarang kita lihat situasi yang berbeda, yaitu reaksi molekul kiral dengan reagen akiral untuk
menghasilkan pusat stereogenik kedua. Contohnya, adisi HBr pada 3-kloro- l-butena. Andaikan kita mulai dengan satu enantiomer murni dari 3-kloro- 1-butena, misalnya isomer R, dengan reaksi digambarkan dalam proyeksi Fischer.
Konfigurasi tempat substituen kloro tetap tidak berubah dan tetap R, tetapi satu pusat stereogenik yang baru dapat berupa R atau S. Jadi, produknya berupa diastereomer.
Apakah produk-produknya berjumlah sama?
DAFTAR PUSTAKA
Hart, H., L. E. Craine dan D.J. Hart. 2003. Kimia Organik. Jakarta: Erlangga.