Pada tahun 1937 Hammett mengusulkan
suatu hubungan kuantitatif untuk menghitung pengaruh substituen terhadap reaktivitas molekul, dimana Gugus
substituen yang tidak mengalami reaksi namum berlokasi di dekat pusat reaksi
mengganggu kekuatan tersebut melalui penarikan elektron atau penyumbangan
elektron, hubungan ini disebut persamaan Hammett.
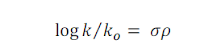 |
| persamaan Hammett |
dengan k = tetapan hidrolisis
ester tersubstitusi meta atau para,
ko =
tetapan hidrolisis yang bekaitan dengan senyawa tak tersubstitusi,
σ = tetapan substituen,
ρ = tetapan raksi.
Persamaan ini menggambarkan pengaruh
substituen polar posisi meta atau para terhadap sisi reaksi turunan benzena.
Persamaan Hammet tidak berlaku untuk substituenpada posisi orto karena adanya
efek sterik, dan juga terhadap turunan alifatik karena pelintiran rantai karbon
dapat menimbulkan aksi sterik. Suatu alur log k/ko lawan σ adalah linier, dan kemiringannya
adalah ρ. Tetapan substituen σ ditetapkan dengan:
 | ||
| Tetapan substituen σ |
dengan
Ko menyatakan tetapan ionisasi asam benzoat, dan K adalah tetapan
ionisasi.
Pada persamaan ini digunakan untuk mengukur
efek polar substituen relatif terhadap hidrogen, efek ini tidak tergantung pada
sifat reaksi. Efek induksi dan efek mesomeri keduanya terkandung dalam
Persamaan ini Tetapan reaksi ρ mengukur
kerentanan reaksi terhadap efek polar, tetapan ini tergantung pada reaksi.
Nilai tetapan beberapa substituen telah
dikumpulkan berdasarkan pada data ionisasi asam benzoat di tunjukkan pada tabel
berikut:
 |
| Nilai tetapan beberapa substituen |
Pada
Tabel Nilai tetapan substituen tersebut telah jelas bahwa nilai σσ bagi beberapa gugus adalah negatif
sedangkan yang lain adalah positif. Nilai negatif bagi gugus amino menunjukkan
peningkatan kerapatan elektron pada pusat reaksi sedangkan nilai positif bagi
nitril menunjukkan penurunan kerapatan elektron. Nilai-nilai tersebut dapat
digunakan sebagai ukuran derajat pengusiran atau penarikan elektron oleh gugus
terhadap cincin benzena.
Persamaan
Hammett terbukti paling sukses digunakan untuk hubungan kuantitatif antara
struktur-struktur senyawa dengan kesetimbangan atau kecepatan reaksi. Akan tetapi
teramati pula adanya penyimpangan dari persaman tersebut. Telah ditemukan adanya
grafik antara logaritme tetapan kecepatan reaksi lawan σ yang non-linear akibat kemampuan
resonansi antara substituen dengan pusat reaksi.
Forum
diskusi: berdasarkan pemaparan materi tersebut maka,
1. Mengapa
kemampuan resonansi antara substituen dengan pusat reaksi dapat menyebabkan penyimpangan
persamaan hammett?
2. Adakah pengaruh nilai positif atau negatif σ pada
sifat suatu senyawa?
DAFTAR PUSTAKA
Firdaus, M.S.2009. Kimia Organik Fisis 1. Makasar: Unhas-press.
Sardjoko.
1993. Rancangan Obat. Yogyakarta:
UGM-Press.